- 9512
- 产品价格:面议
- 发货地址:上海金山石化 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:146095574公司编号:14235332
- 袁小姐 经理 微信 13818104617
- 进入店铺 在线留言 QQ咨询 在线询价
办理MHRA 欢迎在线咨询-需要什么材料
- 相关产品:
办理MHRA
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写,英国MHRA注册,欧盟授权代表,欧盟自由销售证书,ISO13485:2016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
谁应该向主管机关申请/注册?
欧洲经济区EEA的主管机关通常对医疗器械的注册/通告收取一定费用。
对于一般医疗器械:
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
制造 I类 医疗器械或 定制式 (custom-made) 医疗器械,并以你自己的公司名义或商标将其投放于EEA市场;
完全翻新I类医疗器械,或为一个或多个现成的(I类)医疗器械加贴标签,以期把它们以你自己的公司名(或商标)投放于EEA市场;
将市场上现有的带有CE标志的医疗器械,在原制造商的预期使用目的和使用范围内,以你自己的公司名(或商标)置于一个系统或一个程序包之中;
为了能以你自己的公司名(或商标)投放于EEA市场,而对其他制造商制造的消毒后才可使用的系统或程序包或带有CE标志的医疗器械进行消毒处理;
是位于欧洲经济区EEA境外的医疗器械制造商的欧盟授权代表。
如果你是医疗器械制造商但是在欧洲经济区EEA境内没有注册的营业地址的话,你必须*在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。
定制式 (custom-made) 医疗器械是指根据一个专业的书写的处方而为某一个特定的病人专门使用非批量生产而制作的器械。
对于体外诊断医疗器械(IVD):
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
制造体外诊断医疗器械(IVD),并以你自己的公司名义或商标将其投放于EEA市场;
以你自己的公司名义或商标制造供性能评估用的体外诊断医疗器械(IVD);
是一个在欧洲经济区EEA境内没有注册营业地址的体外诊断医疗器械(IVD)制造商的欧盟授权代表。
如果你在欧洲经济区EEA境内没有注册的营业地址,而希望将体外诊断医疗器械(IVD)投放EEA市场的话,你必须*在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。

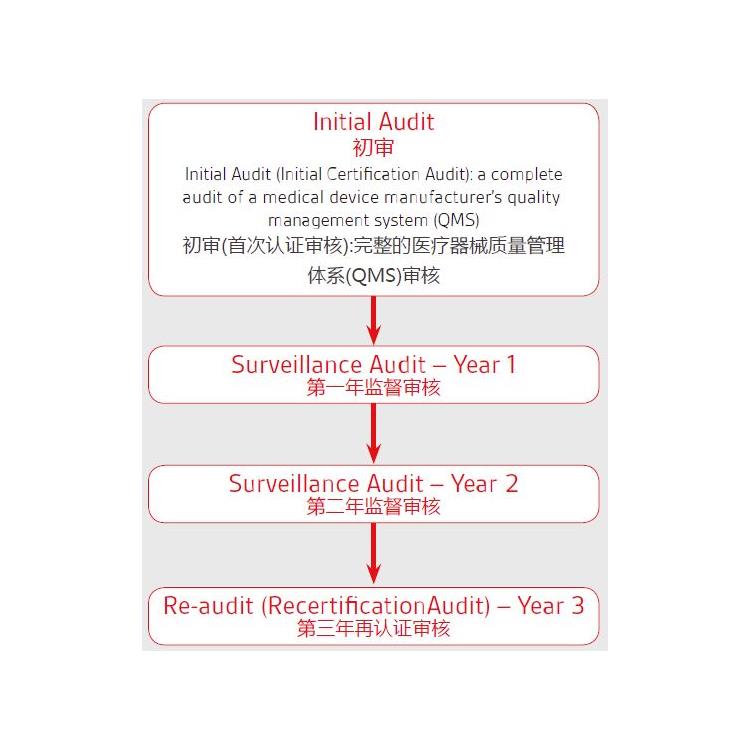
MHRA医疗器械注册:I类的医疗器械出口到欧洲欧盟需要在成员国的主管当局进行注册

英国MHRA注册,MHRA自由销售证书
MHRA注册完成获得MHRA注册信函和MHRA注册号码
欧盟注册
欧盟的法律要求,非欧盟的医疗器械制造商在加贴CE标志, 印刷标签和说明书时,必须印上制造商和制造商的欧盟代表的名称和地址。
所有体外诊断医疗器械IVDD(包括试剂)以及所有I类医疗器械MDD, 在加贴CE标志时,就必须委托欧盟代表将制造商及产品信息在欧盟境内注册,进入欧盟数据库。
出口前,要完成在欧盟境内注册,以免进入欧盟海关时出问题。
欧盟药监局注册(英国MHRA注册)
为什么要注册MHRA?
这是一个法律的要求,制造商(或其授权的代表或其他人)将医疗器械或体外诊断医疗设备投放到欧盟市场,需要通过欧盟代表进行注册,获得注册号并输入欧盟医疗器械数据库。
注册意味着什么?
如果你在英国注册,MHRA承认你的注册,分配和通知你相应的注册号。如果我们需要任何进一步的信息,我们会联系你。每个申请者会有一个单一的注册号,覆盖由专人负责登记的所有设备。最后,按照指令(的IVD指令;12条医疗器械指令第14A),你的器械相关的数据将进入欧洲数据库(Eudamed)。
何时注册?
当你**次使用CE标志到您的设备上时,你必须通知主管机关进行注册。如果你有一些型号的产品正在导入CE标志的程序中,你也可以在完成了**个设备的CE标记时一并通知主管机关,并对所有的设备进行注册。定制的设备,系统或程序包制造商,和消毒的公司,须不迟于他们**次声明满足指令要求时进行注册。
如果你是一个注册在英国的企业,你可以在英国主管机关(MHRA)进行注册。如果你也有在欧盟其他成员国的企业,你可以选择向其中的一个,而不一定要是英国的,但是你必须通知你所注册的营业场所所在国的主管当局。
如果你实施的是另一个成员国注册,而不是英国的,你应该从该成员国的主管当局寻求信息。

一类医疗器械需要授权代表完成英国MHRA注册获得注册信函
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写,英国MHRA注册,欧盟授权代表,欧盟自由销售证书,ISO13485:2016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
谁应该向主管机关申请/注册?
欧洲经济区EEA的主管机关通常对医疗器械的注册/通告收取一定费用。
对于一般医疗器械:
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
制造 I类 医疗器械或 定制式 (custom-made) 医疗器械,并以你自己的公司名义或商标将其投放于EEA市场;
完全翻新I类医疗器械,或为一个或多个现成的(I类)医疗器械加贴标签,以期把它们以你自己的公司名(或商标)投放于EEA市场;
将市场上现有的带有CE标志的医疗器械,在原制造商的预期使用目的和使用范围内,以你自己的公司名(或商标)置于一个系统或一个程序包之中;
为了能以你自己的公司名(或商标)投放于EEA市场,而对其他制造商制造的消毒后才可使用的系统或程序包或带有CE标志的医疗器械进行消毒处理;
是位于欧洲经济区EEA境外的医疗器械制造商的欧盟授权代表。
如果你是医疗器械制造商但是在欧洲经济区EEA境内没有注册的营业地址的话,你必须*在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。
定制式 (custom-made) 医疗器械是指根据一个专业的书写的处方而为某一个特定的病人专门使用非批量生产而制作的器械。
对于体外诊断医疗器械(IVD):
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
制造体外诊断医疗器械(IVD),并以你自己的公司名义或商标将其投放于EEA市场;
以你自己的公司名义或商标制造供性能评估用的体外诊断医疗器械(IVD);
是一个在欧洲经济区EEA境内没有注册营业地址的体外诊断医疗器械(IVD)制造商的欧盟授权代表。
如果你在欧洲经济区EEA境内没有注册的营业地址,而希望将体外诊断医疗器械(IVD)投放EEA市场的话,你必须*在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。

MHRA医疗器械注册:I类的医疗器械出口到欧洲欧盟需要在成员国的主管当局进行注册

英国MHRA注册,MHRA自由销售证书
MHRA注册完成获得MHRA注册信函和MHRA注册号码
欧盟注册
欧盟的法律要求,非欧盟的医疗器械制造商在加贴CE标志, 印刷标签和说明书时,必须印上制造商和制造商的欧盟代表的名称和地址。
所有体外诊断医疗器械IVDD(包括试剂)以及所有I类医疗器械MDD, 在加贴CE标志时,就必须委托欧盟代表将制造商及产品信息在欧盟境内注册,进入欧盟数据库。
出口前,要完成在欧盟境内注册,以免进入欧盟海关时出问题。
欧盟药监局注册(英国MHRA注册)
为什么要注册MHRA?
这是一个法律的要求,制造商(或其授权的代表或其他人)将医疗器械或体外诊断医疗设备投放到欧盟市场,需要通过欧盟代表进行注册,获得注册号并输入欧盟医疗器械数据库。
注册意味着什么?
如果你在英国注册,MHRA承认你的注册,分配和通知你相应的注册号。如果我们需要任何进一步的信息,我们会联系你。每个申请者会有一个单一的注册号,覆盖由专人负责登记的所有设备。最后,按照指令(的IVD指令;12条医疗器械指令第14A),你的器械相关的数据将进入欧洲数据库(Eudamed)。
何时注册?
当你**次使用CE标志到您的设备上时,你必须通知主管机关进行注册。如果你有一些型号的产品正在导入CE标志的程序中,你也可以在完成了**个设备的CE标记时一并通知主管机关,并对所有的设备进行注册。定制的设备,系统或程序包制造商,和消毒的公司,须不迟于他们**次声明满足指令要求时进行注册。
如果你是一个注册在英国的企业,你可以在英国主管机关(MHRA)进行注册。如果你也有在欧盟其他成员国的企业,你可以选择向其中的一个,而不一定要是英国的,但是你必须通知你所注册的营业场所所在国的主管当局。
如果你实施的是另一个成员国注册,而不是英国的,你应该从该成员国的主管当局寻求信息。

一类医疗器械需要授权代表完成英国MHRA注册获得注册信函