- 1124
- 产品价格:999.00 元/个 起
- 发货地址:上海浦东金桥 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:148649020公司编号:14618482
- 袁阳 经理 微信 134726246..
- 进入店铺 在线咨询 QQ咨询 在线询价
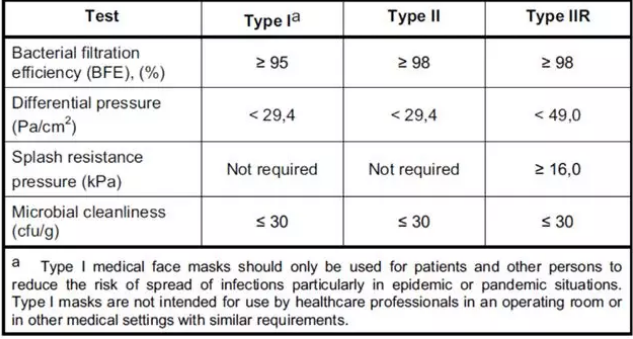
郑州非灭菌口罩CE认证费用和周期
- 相关产品:
医疗器械CE认证
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
CE标志有何重要意义
CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合安全要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或退出市场。
CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有CE标志。显然,CE标志可作为器械在欧盟内的“通行证”。同时,一个医疗器械产品如果合法加贴了CE标志,也就表明:
1、 该医疗器械符合了欧盟医疗器械法规的基本要求;
2、 该医疗器械可以在欧盟市场内自由流通、销售及使用;
3、 该医疗器械的整个形成过程已通过了一个相应的符合性评价程序。
欧盟医疗器械CE指令
在医疗器械领域,欧盟会制定发布了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。 这三个指令分别是:
1.基础医疗器械指令(MDD,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
2.体外诊断器械指令(IVDD,98/79/EC),适用于血细胞计数器,血糖仪、妊娠检测试纸、诊断、优生诊断等体外诊断用医疗器械产品。
3.有源植入性医疗器械指令(AIMDD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性医疗器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上销售。
CE技术文件
CE技术文件是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。各欧盟指令对于"技术档案"的要求有所差别,在这里谨以中国出口企业常用的“医疗器械”的要求为例,加以说明。
医疗器械指令93/42/EEC要求"技术档案"可能包含:企业的质量手册和程序文件;企业简介及欧洲代表名称、联系方式;CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料),主要内容如下:
1、产品名称、分类
2、产品概述(包括类型和预期用途)
◇产品的历史沿革
◇技术性能参数
◇产品配合使用的附件、配合件和其它设备清单
◇产品的图示与样品
◇产品所用原材料及供应商
3、使用该产品的调和标准/或其它标准
(袁 (1381电8104话617)
4、风险分析评估结论和预防措施
5、生产质量控制
◇产品资料和控制文档(包括产品生产工艺流程图)
◇产品的灭菌方法和确认的描述
◇灭菌验证
◇产品质量控制措施
◇产品稳定性和效期的描述
6、包装和标识
◇包装材料说明
◇标签
◇使用说明书
7、技术评价
◇产品检验报告及相关文献
◇技术概要及*观点
8、风险管理
◇产品潜在风险报告及相关文献
◇潜在风险的概要及*观点
9、临床评价
◇产品临床测试报告及相关文献
◇临床使用概述及*观点
附1、产品出厂检测报告
附2、产品型式检测报告
附3、基本要求检查表
备注:
◇临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
◇生物兼容性测试(A)部分要求:细胞毒性、感光性、-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性; (B)支持测试:慢性中毒、致性、再生性/生长性、生物动因退化。)
◇临床资料(需要临床研究或描述临床研究)
◇包装合格证明
◇标签、使用说明
◇结论(设计档案资料的接受、利益对应风险的陈述)
10、欧盟授权代表信息及协议
11、符合基本要求表
12、协调标准
13、警戒系统程序
一、CE标志有何重要意义
CE标志的意义在于: 用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求( Essential Requirements), 并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明, 真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品, 没有CE标志的, 不得上市销售, 已加贴CE标志进入市场的产品, 发现不符合安全要求的, 要责令从市场收回, 持续违反指令有关CE标志规定的, 将被限制或禁止进入欧盟市场或退出市场。
二、使用CE标志, 需要经过哪些合法程序?
厂商可按下列主要步骤操作 :
1.根据指令关于使用CE标志应通过何种合格评定模式的要求、合格评定的原则和93/465/EEC号理事会指令, 在八种认证模式中选取合适的模式。
2.根据指令要求采取自我评定或申请第三方评定或强制申请欧共体通知程序认可认证机构评定后, 编制制造商自我评定的一致性声明和(或)认可认证机构的CE证书, 作为可以或准许使用CE标志的前提条件。
3.由制造商按有关指令规定在通过规定模式的合格评定后, 自行制作或加附CE标志及有关指令规定的附加信息。
4.有关指令规定应在CE标志部位, 接着加附认可认证机构的识别编号时, 应由执行合格评定的认可认证机构自行加附, 或授权制造商或其在欧共体的代理商负责加附。对特别危险的产品, 指令中规定由强制性认可认证机构进行产品样品试验和(或)质量体系认可的, 均应先取得评定认可, 才能获准使用CE标志。
三、CE标志的接受对象是谁?
CE标志的接受对象为欧共体成员国负责实行市场产品安全控制的国家监管当局, 而非顾客, 当一个产品已加附CE标志时, 成员国负责销售安全监督的当局应假定其符合指令主要要求, 可在欧共体市场自由流通。
四、谁对CE标志的正确性负责?
制造商或其代理商, 或欧盟成员国的进口商必须对CE标志的正确性负责。
五、CE标志是否可供广告之用?
CE标志是为的市场销售产品安全控制而设计的, 不是为消费者制作的, 也不是推销工具, 因此不适合作为广告。但是, 在制作您的产品目录时, 别忘了在目录中印上合法取得的CE标志。
I级医疗器械CE认证标记:
与其他类型的医疗设备相比,I类医疗设备被视为低风险设备。根据欧洲MDD,非无菌且不可测量的I类设备免于公告机构审核和认证。
牙科椅设备CE认证
1类医疗器械-示例
手臂、吊带、牙科椅、考试服、钳子、面具、病床可、重复使用的手术器械
夹板、灭菌包装、袜、de降压器
牙刷、尿袋、轮椅
1类设备可以分为三种,[a] 1类设备,[b] 1类无菌设备,[c] 1类测量设备:
[a] 1类设备
所有1类医疗设备都可以通过准备符合性声明并符合其他要求的自我声明来粘贴CE认证标志。但是大多数制造商仍然依赖第三方认证来获得的CE认证证书。
[b] I类无菌设备
等级1的无菌医疗器械CE认证标记,必须经过通知的身体参与。1级无菌制造商应执行ISO 13485并推荐认证,GMP控制是必要的。
[c] 1类测量设备
只有通过遵守MDD要求和协调标准,然后将技术文件提交*机构和现场审核,才能完成1类测量设备的CE认证标记过程。另外MEDDEV2。应遵循1/5指南。
怎么判断医疗设备-Class Im(测量设备)?
确定具有测量功能的设备的标准。
如果同时满足以下条件,则表明该设备具有测量功能:
1.该设备旨在定量地测量生理或解剖学参数,或者-测量能量或传递给人体或从人体去除的物质的数量或合格特性。
2.测量结果以法令80/181 / EEC的含义以法定单位或其他可接受的单位显示,或者与符合前述指令的法定单位或其他可接受的单位中指示的至少一个参考点进行比较。
3.预期目的隐含了明确或隐含要求的准确性。
本建议书不涵盖制造过程中的测量活动(包括用于校准目的的测量活动),并不表示制造的设备具有测量功能。
具有测量功能的I类设备的示例:
1.用于测量体温的非活动设备。
2.包括非活动温度显示的奶嘴。
3.用于指示体温**或低于*值的设备。
4.用于测量血压的非主动非侵入式设备。
5.用于测量眼压的非主动装置。
6.用于测量输送到人体或从人体排出的液体或气体的体积或流量的设备。
7.用于将液体输送到人体的设备(例如药勺,杯子,滴管,没有刻度或刻度)。
8.用于显示生理参数趋势的设备(例如没有刻度或刻度的尿液引流袋,肥胖卡尺)。
9.视力表
注:-假设相关的分类规则允许在类中分类,但前提是要满足相关的标准。
具有测量功能的1类设备在无菌条件下包装和提供,需要提供《合格机构证明》,而非无菌1类测量设备则不需要!
ISO 13485是自愿的
Ir类可重复使用的手术器械CE认证:
欧盟MDR 2017/745引入了可重复使用手术器械的新要求。所有可重复使用的手术器械均属于1r级,并需要经过认证机构的合格评定。
可重复使用的手术器械被定义为“在切割,钻孔,锯切,刮擦,刮擦,夹持,缩回,修剪或类似程序中用于外科手术的器械,未连接有源设备,制造商打算在使用后重新使用”已经执行了适当的程序,例如清洁,消毒和灭菌
外科手术器械CE认证
可以通过以下方法实现*20.1、20.3、20.4和20.5条以及*52条(7c)规定的MDR类Ir CE认证标记:
1.检验和测试每种产品或同类产品(附件IV)
2.根据附件VIII*1章*2.3节(附件V)和EN ISO 13485:2016审核生产质量保证体系(不包括设计)
3.终检验和测试审核(附件VI)EN ISO 13485:2016(不包括设计与制造)
4.全面质量保证体系审核(附件II)EN ISO 13485:2016
CE分类可能会因预期用途而异,请与MDD 93/42/EEC附件IX核对您的设备分类。
我们可以协助您:
1.医疗器械分类
2.确定MDR要求
3.确定统一标准
4.ISO 13485实施
5.识别公告机构
6.技术文件准备
7.技术文件提交给公告机构
8.重新提交技术文件
9.协助公告机构审核
10.协助解决不合格项
11.贴上CE认证标志
医疗器械ce技术文档
CE MDR认证中REGULATION (EU) 2017/745,简称“MDR”
我公司是做:
1:新MDR法规和MDD指令的欧盟CE认证,CE*四版临床评价报告更新/编写
2:欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国),
3:ISO9001/ISO13485认证以及咨询辅导
4:FDA注册,FDA510K,FDA验厂辅导/陪审和翻译
5:MDSAP咨询辅导,国内注册证,生产许可证的办理
根据TUV莱茵消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。
由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。
2017年5月5日,欧盟期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效
MDR已从指令升级为监管,这增强了其对欧盟成员国的约束力,并具有直接约束力。*各国转换为国家法律法规即可实施。在内容方面,MDR基于原始指令的整合,大大改进了医疗器械认证的规范和限制,例如产品分类规则,设备可追溯性,临床性能研究规范,上市后产品安全性提高以及有效性方面和监管。 MDR由10章和123篇文章组成,共17个附录。
关于监管的过渡期:
仅拥有根据指令90/385/EEC和93/42/EEC颁发的证书的设备可以投放市场,前提是自MDR应用之日起设计和预期用途没有发生重大变化且符合要求新规定。监管,市场监督,警报,经济运营和设备登记的规定。
可通过免税订单获得,符合新规定的设备可在2020年5月26日前投放市场。符合新规定的合格评定机构可在2020年5月26日前*并通知。可以采用合规合规评估程序,并在2020年5月26日之前根据新规定颁发证书。
关于MDR涵盖产品范围和分类规则:
医疗器械的分类继续以前的类别,根据风险等级分为四类:I,II a,II b,III。但是,分类规则从18增加到22.具体分类规则的条件和变化如下:
关于经济运营商的义务:
该法规在章*2条的定义中提出了“经济运营者”的概念。经济运营者是指制造商,授权代表,进口商,分销商以及系统或手术袋的任何组合或消毒。投放市场的自然人或法人。也就是说,负责按照法规生产设备(包括组合或灭菌),销售和上市后操作的自然人或法人
其他:
*17条规定,一次性医疗器械的再利用只能在相应的国家法律允许的情况下进行,并应符合MDR规定。任何重新处理一次性设备或重新使用它的自然人或法人应被视为多路复用设备的制造商,并应承担制造商的义务,包括设备的可追溯性。但是,目前只有一些欧盟成员国接受设备再利用并有相应的规定。
欧盟授权代表、MDD/MDR CE认证咨询辅导、新版临床评估报告编写服务 (1381电8104话617)
MDR的主要变化:
1.扩大申请范围
2.提出的新概念和设备定义
3.优化医疗器械的分类
4.提高设备的一般安全性和性能要求
5.加强对技术文件的要求
6.设备上市后加强监督
7.提高临床评估的相关要求
8.建议建立和使用Eudamed数据库
9.提出设备可追溯性(UDI)
10. NB的严格要求
给企业一些建议:
•监管要求的大幅增加对制造商(特别是中小企业)产生了巨大影响
•增加人才**性:制造商,*机构,*组,欧盟授权代表等需要熟悉法规,技术和人员
•尽早开始准备!
•检查产品分类和合规途径是否受到影响!
•内部自我检查,以确保技术文件:符合的技术要求;特别是临床评估!满足语言要求
•了解MDR和内部差距分析的变化
•选择一个稳定,成熟的公告机构!
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海浦东金桥世纪大道1500号,联系人是袁阳。我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
CE标志有何重要意义
CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合安全要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或退出市场。
CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有CE标志。显然,CE标志可作为器械在欧盟内的“通行证”。同时,一个医疗器械产品如果合法加贴了CE标志,也就表明:
1、 该医疗器械符合了欧盟医疗器械法规的基本要求;
2、 该医疗器械可以在欧盟市场内自由流通、销售及使用;
3、 该医疗器械的整个形成过程已通过了一个相应的符合性评价程序。
欧盟医疗器械CE指令
在医疗器械领域,欧盟会制定发布了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。 这三个指令分别是:
1.基础医疗器械指令(MDD,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
2.体外诊断器械指令(IVDD,98/79/EC),适用于血细胞计数器,血糖仪、妊娠检测试纸、诊断、优生诊断等体外诊断用医疗器械产品。
3.有源植入性医疗器械指令(AIMDD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性医疗器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上销售。
CE技术文件
CE技术文件是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。各欧盟指令对于"技术档案"的要求有所差别,在这里谨以中国出口企业常用的“医疗器械”的要求为例,加以说明。
医疗器械指令93/42/EEC要求"技术档案"可能包含:企业的质量手册和程序文件;企业简介及欧洲代表名称、联系方式;CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料),主要内容如下:
1、产品名称、分类
2、产品概述(包括类型和预期用途)
◇产品的历史沿革
◇技术性能参数
◇产品配合使用的附件、配合件和其它设备清单
◇产品的图示与样品
◇产品所用原材料及供应商
3、使用该产品的调和标准/或其它标准
(袁 (1381电8104话617)
4、风险分析评估结论和预防措施
5、生产质量控制
◇产品资料和控制文档(包括产品生产工艺流程图)
◇产品的灭菌方法和确认的描述
◇灭菌验证
◇产品质量控制措施
◇产品稳定性和效期的描述
6、包装和标识
◇包装材料说明
◇标签
◇使用说明书
7、技术评价
◇产品检验报告及相关文献
◇技术概要及*观点
8、风险管理
◇产品潜在风险报告及相关文献
◇潜在风险的概要及*观点
9、临床评价
◇产品临床测试报告及相关文献
◇临床使用概述及*观点
附1、产品出厂检测报告
附2、产品型式检测报告
附3、基本要求检查表
备注:
◇临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
◇生物兼容性测试(A)部分要求:细胞毒性、感光性、-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性; (B)支持测试:慢性中毒、致性、再生性/生长性、生物动因退化。)
◇临床资料(需要临床研究或描述临床研究)
◇包装合格证明
◇标签、使用说明
◇结论(设计档案资料的接受、利益对应风险的陈述)
10、欧盟授权代表信息及协议
11、符合基本要求表
12、协调标准
13、警戒系统程序
一、CE标志有何重要意义
CE标志的意义在于: 用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求( Essential Requirements), 并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明, 真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品, 没有CE标志的, 不得上市销售, 已加贴CE标志进入市场的产品, 发现不符合安全要求的, 要责令从市场收回, 持续违反指令有关CE标志规定的, 将被限制或禁止进入欧盟市场或退出市场。
二、使用CE标志, 需要经过哪些合法程序?
厂商可按下列主要步骤操作 :
1.根据指令关于使用CE标志应通过何种合格评定模式的要求、合格评定的原则和93/465/EEC号理事会指令, 在八种认证模式中选取合适的模式。
2.根据指令要求采取自我评定或申请第三方评定或强制申请欧共体通知程序认可认证机构评定后, 编制制造商自我评定的一致性声明和(或)认可认证机构的CE证书, 作为可以或准许使用CE标志的前提条件。
3.由制造商按有关指令规定在通过规定模式的合格评定后, 自行制作或加附CE标志及有关指令规定的附加信息。
4.有关指令规定应在CE标志部位, 接着加附认可认证机构的识别编号时, 应由执行合格评定的认可认证机构自行加附, 或授权制造商或其在欧共体的代理商负责加附。对特别危险的产品, 指令中规定由强制性认可认证机构进行产品样品试验和(或)质量体系认可的, 均应先取得评定认可, 才能获准使用CE标志。
三、CE标志的接受对象是谁?
CE标志的接受对象为欧共体成员国负责实行市场产品安全控制的国家监管当局, 而非顾客, 当一个产品已加附CE标志时, 成员国负责销售安全监督的当局应假定其符合指令主要要求, 可在欧共体市场自由流通。
四、谁对CE标志的正确性负责?
制造商或其代理商, 或欧盟成员国的进口商必须对CE标志的正确性负责。
五、CE标志是否可供广告之用?
CE标志是为的市场销售产品安全控制而设计的, 不是为消费者制作的, 也不是推销工具, 因此不适合作为广告。但是, 在制作您的产品目录时, 别忘了在目录中印上合法取得的CE标志。
I级医疗器械CE认证标记:
与其他类型的医疗设备相比,I类医疗设备被视为低风险设备。根据欧洲MDD,非无菌且不可测量的I类设备免于公告机构审核和认证。
牙科椅设备CE认证
1类医疗器械-示例
手臂、吊带、牙科椅、考试服、钳子、面具、病床可、重复使用的手术器械
夹板、灭菌包装、袜、de降压器
牙刷、尿袋、轮椅
1类设备可以分为三种,[a] 1类设备,[b] 1类无菌设备,[c] 1类测量设备:
[a] 1类设备
所有1类医疗设备都可以通过准备符合性声明并符合其他要求的自我声明来粘贴CE认证标志。但是大多数制造商仍然依赖第三方认证来获得的CE认证证书。
[b] I类无菌设备
等级1的无菌医疗器械CE认证标记,必须经过通知的身体参与。1级无菌制造商应执行ISO 13485并推荐认证,GMP控制是必要的。
[c] 1类测量设备
只有通过遵守MDD要求和协调标准,然后将技术文件提交*机构和现场审核,才能完成1类测量设备的CE认证标记过程。另外MEDDEV2。应遵循1/5指南。
怎么判断医疗设备-Class Im(测量设备)?
确定具有测量功能的设备的标准。
如果同时满足以下条件,则表明该设备具有测量功能:
1.该设备旨在定量地测量生理或解剖学参数,或者-测量能量或传递给人体或从人体去除的物质的数量或合格特性。
2.测量结果以法令80/181 / EEC的含义以法定单位或其他可接受的单位显示,或者与符合前述指令的法定单位或其他可接受的单位中指示的至少一个参考点进行比较。
3.预期目的隐含了明确或隐含要求的准确性。
本建议书不涵盖制造过程中的测量活动(包括用于校准目的的测量活动),并不表示制造的设备具有测量功能。
具有测量功能的I类设备的示例:
1.用于测量体温的非活动设备。
2.包括非活动温度显示的奶嘴。
3.用于指示体温**或低于*值的设备。
4.用于测量血压的非主动非侵入式设备。
5.用于测量眼压的非主动装置。
6.用于测量输送到人体或从人体排出的液体或气体的体积或流量的设备。
7.用于将液体输送到人体的设备(例如药勺,杯子,滴管,没有刻度或刻度)。
8.用于显示生理参数趋势的设备(例如没有刻度或刻度的尿液引流袋,肥胖卡尺)。
9.视力表
注:-假设相关的分类规则允许在类中分类,但前提是要满足相关的标准。
具有测量功能的1类设备在无菌条件下包装和提供,需要提供《合格机构证明》,而非无菌1类测量设备则不需要!
ISO 13485是自愿的
Ir类可重复使用的手术器械CE认证:
欧盟MDR 2017/745引入了可重复使用手术器械的新要求。所有可重复使用的手术器械均属于1r级,并需要经过认证机构的合格评定。
可重复使用的手术器械被定义为“在切割,钻孔,锯切,刮擦,刮擦,夹持,缩回,修剪或类似程序中用于外科手术的器械,未连接有源设备,制造商打算在使用后重新使用”已经执行了适当的程序,例如清洁,消毒和灭菌
外科手术器械CE认证
可以通过以下方法实现*20.1、20.3、20.4和20.5条以及*52条(7c)规定的MDR类Ir CE认证标记:
1.检验和测试每种产品或同类产品(附件IV)
2.根据附件VIII*1章*2.3节(附件V)和EN ISO 13485:2016审核生产质量保证体系(不包括设计)
3.终检验和测试审核(附件VI)EN ISO 13485:2016(不包括设计与制造)
4.全面质量保证体系审核(附件II)EN ISO 13485:2016
CE分类可能会因预期用途而异,请与MDD 93/42/EEC附件IX核对您的设备分类。
我们可以协助您:
1.医疗器械分类
2.确定MDR要求
3.确定统一标准
4.ISO 13485实施
5.识别公告机构
6.技术文件准备
7.技术文件提交给公告机构
8.重新提交技术文件
9.协助公告机构审核
10.协助解决不合格项
11.贴上CE认证标志
医疗器械ce技术文档
CE MDR认证中REGULATION (EU) 2017/745,简称“MDR”
我公司是做:
1:新MDR法规和MDD指令的欧盟CE认证,CE*四版临床评价报告更新/编写
2:欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国),
3:ISO9001/ISO13485认证以及咨询辅导
4:FDA注册,FDA510K,FDA验厂辅导/陪审和翻译
5:MDSAP咨询辅导,国内注册证,生产许可证的办理
根据TUV莱茵消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。
由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。
2017年5月5日,欧盟期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效
MDR已从指令升级为监管,这增强了其对欧盟成员国的约束力,并具有直接约束力。*各国转换为国家法律法规即可实施。在内容方面,MDR基于原始指令的整合,大大改进了医疗器械认证的规范和限制,例如产品分类规则,设备可追溯性,临床性能研究规范,上市后产品安全性提高以及有效性方面和监管。 MDR由10章和123篇文章组成,共17个附录。
关于监管的过渡期:
仅拥有根据指令90/385/EEC和93/42/EEC颁发的证书的设备可以投放市场,前提是自MDR应用之日起设计和预期用途没有发生重大变化且符合要求新规定。监管,市场监督,警报,经济运营和设备登记的规定。
可通过免税订单获得,符合新规定的设备可在2020年5月26日前投放市场。符合新规定的合格评定机构可在2020年5月26日前*并通知。可以采用合规合规评估程序,并在2020年5月26日之前根据新规定颁发证书。
关于MDR涵盖产品范围和分类规则:
医疗器械的分类继续以前的类别,根据风险等级分为四类:I,II a,II b,III。但是,分类规则从18增加到22.具体分类规则的条件和变化如下:
关于经济运营商的义务:
该法规在章*2条的定义中提出了“经济运营者”的概念。经济运营者是指制造商,授权代表,进口商,分销商以及系统或手术袋的任何组合或消毒。投放市场的自然人或法人。也就是说,负责按照法规生产设备(包括组合或灭菌),销售和上市后操作的自然人或法人
其他:
*17条规定,一次性医疗器械的再利用只能在相应的国家法律允许的情况下进行,并应符合MDR规定。任何重新处理一次性设备或重新使用它的自然人或法人应被视为多路复用设备的制造商,并应承担制造商的义务,包括设备的可追溯性。但是,目前只有一些欧盟成员国接受设备再利用并有相应的规定。
欧盟授权代表、MDD/MDR CE认证咨询辅导、新版临床评估报告编写服务 (1381电8104话617)
MDR的主要变化:
1.扩大申请范围
2.提出的新概念和设备定义
3.优化医疗器械的分类
4.提高设备的一般安全性和性能要求
5.加强对技术文件的要求
6.设备上市后加强监督
7.提高临床评估的相关要求
8.建议建立和使用Eudamed数据库
9.提出设备可追溯性(UDI)
10. NB的严格要求
给企业一些建议:
•监管要求的大幅增加对制造商(特别是中小企业)产生了巨大影响
•增加人才**性:制造商,*机构,*组,欧盟授权代表等需要熟悉法规,技术和人员
•尽早开始准备!
•检查产品分类和合规途径是否受到影响!
•内部自我检查,以确保技术文件:符合的技术要求;特别是临床评估!满足语言要求
•了解MDR和内部差距分析的变化
•选择一个稳定,成熟的公告机构!
联系电话是021-80188750, 主要经营SUNGO集团专注于MDRCE认证、FDA注册和FDA510K、欧盟自由销售证明、FDA验厂、CE临床评估报告、欧盟授权代表和欧盟注册等,经验丰富,值得信赖,欢迎广大客户来电咨询。。
单位注册资金单位注册资金人民币 500 - 1000 万元。