- 341
- 产品价格:面议
- 发货地址:湖北武汉江汉区 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:238970293公司编号:14192389
- 蒋小姐 商务代表 微信 180071419..
- 进入店铺 在线咨询 QQ咨询 在线询价
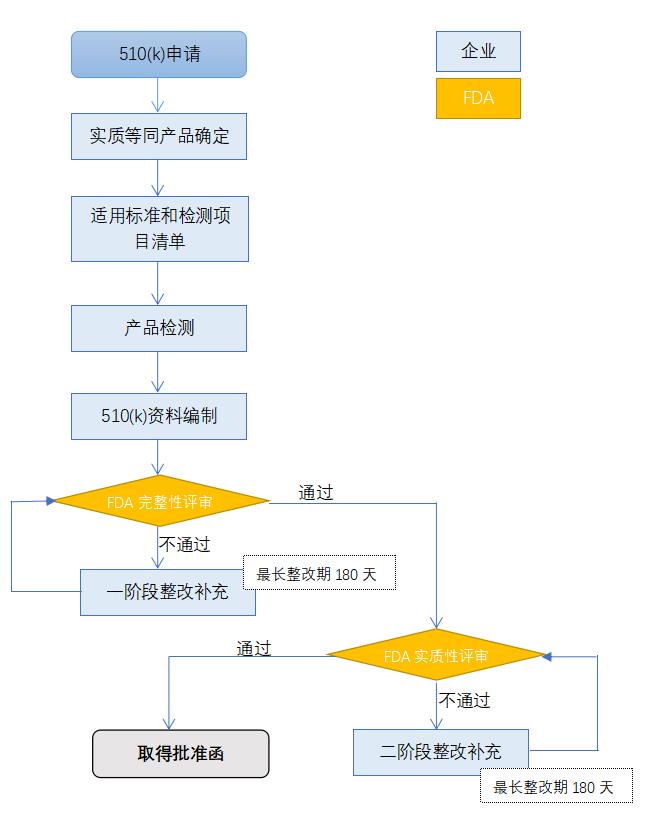
盐城欧盟IVDR认证流程
- 相关产品:
IVDR CE认证为避免由于法规切换而造成对现有医疗系统的冲击,实现法规的“软着陆”,IVDR法规从生效(Entry into Force)到实施(Application)期间有5年的过渡期。IVDR法规的生效日为2017年5月25日,强制实施日为2022年5月26日。
欧盟的IVDR,同样也引入UDI的要求,以增强产品的追溯以及上市后的管理。与FDA的要求一样,IVDR中所提出的UDI同样是由一个固定的产品识别码(Device Identifier,DI)和一个非固定的生产识别码(Production Identifier,PI)组成。生产企业在实施UDI的过程中,需要明确各产品的UDI代码及所包含的信息,并在产品上加贴UDI标贴,同时以电子形式存储UDI相关信息并在Eudamed系统上申报。
在欧盟市场上上市的医疗器械产品都必须有CE标志,而获得CE标志的使用权需要通过主管当局的审核,IVDR就是这类审核的法规。由于之前的IVDD大多数产品都是自我宣称模式进行,而在IVDR下将90%的体外医疗诊断器械产品都纳入监看了,需要实质上的注册过程,所以可以简单地把IVDR认证理解成新的体外医疗诊断器械CE认证。
IVDR CE认证加强了体系管理,对高风险设备增加了相关规定比如对于非医疗用途但具有与医疗器械相似特性的设备也将受到新法规的管辖,提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、医疗设备将有一个识别号这加强其在整个供应链的可追溯性。
体外诊断医疗器械IVDR CE认证的一般步骤:
1、分析该器械的特点,确定它所属的指令范围;
2、确定该器械的分类(风险分级);
3、选择相应的符合性评价程序;
4、选择公告机构;
5、确认适用的基本要求/有关的协调标准;
6、确认该器械满足基本要求/协调标准, 并使证据文件化;
7、欧盟授权代表;
8、欧洲注册;
9、对于需要公告机构评审的器械,通过公告机构的符合性程序;
10、起草符合性声明并加贴CE标志。
我们公司本着“客户**、服务至上”的宗旨,牢记“让每个客户都用好产品”的使命,与各界朋友广泛合作,携手共进,共创美好未来。
联系电话是17717017570, 主要经营上海沙格医疗科技有限公司武汉分公司(咨询电话:18007141921)是一家QSR820验厂,主营:IVDR CE认证、MDR CE认证、英国UKCA认证、FDA产品测试、ISO13485体系认证等服务。十多年里,SUNGO已为**30多家上市公司和**制造商,合计5000多家企业提供过相关服务。。
单位注册资金单位注册资金人民币 100 万元以下。