- 9012
- 产品价格:面议
- 发货地址:上海金山 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:245933222公司编号:14235332
- 袁小姐 经理 微信 13818104617
- 进入店铺 在线留言 QQ咨询 在线询价
怎么做ISO13485认流程和ISO9001认流程
- 相关产品:
新标准作了许多性规定。
4.2.1增加了“对每一型号/类型的器械建立和保持一套文档,”
4.2.3增加了保存作废文件规定。
4.2.4记录控制规定:"组织保存记录的期限应至少相当于组织所规定的器械的寿命期。"
5.5.2管理者代表的职责和权限c)要求,"确保在整个组织内提高满足法规要求和顾客要求的意识。"
5.6.2管理评审输入增加了"h)新的或修订的法规要求。"
4.6.4工作环境中增加了对产品清洁、防止污染。
7.1产品实现的策划中增加了风险管理的内容。
7.2.3顾客沟通中增加了"d)忠告性通知。"
7.3.1设计和开发策划b)指出,"适合于每个设计和开发阶段的评审、验、确认和设计转换活动(注:设计和开发过程中设计转换活动可确保设计和开发输出在成为终产品规范前得以验,以确保其适于制造)。"
7.3.2设计和开发输入a)改为,"根据预期用途,规定的功能、性能和要求",并增加了"e)风险管理的输出。"
7.3.3设计和开发输出增加了"应保持设计和开发输出的记录(注:设计和开发输出的记录可包括规范、制造程序、工程图纸、工程或研究历程记录)"。
7.3.4设计和开发评审的参加者增加了"其他人员。"
7.3.5设计和开发的确认规定,"作为设计和开发确认活动的一部分,如或地区的法规要求,组织应实施器械评价和/或性能评价。"
7.4.2采购信息规定"按照7.5.3.2规定的可追溯性要求的范围和程度, 组织应保持相关的采购信息,如文件和记录。"
ISO13485的2016版本咨询、培训多少钱?
ISO13845: 二016认、ISO9001: 二015认和ISO14001: 二015认和咨询
ISO9001/ISO13485
• 质量管理体系;
• ISO9001是适用于所有行业的标准,包括器械行业;
• ISO13485是适用于器械行业的标准。
ISO13485器械质量管理体系,是基于ISO9001国际质量管理体系要求增加了对器械行业的特定要求建立的国际标准,它对器械生产企业的质量管理体系提出了要求,为器械的质量达到有效起到了很好的促进作用,也是器械产品出口国外时,国外客户对企业产品有信心的有力依据。
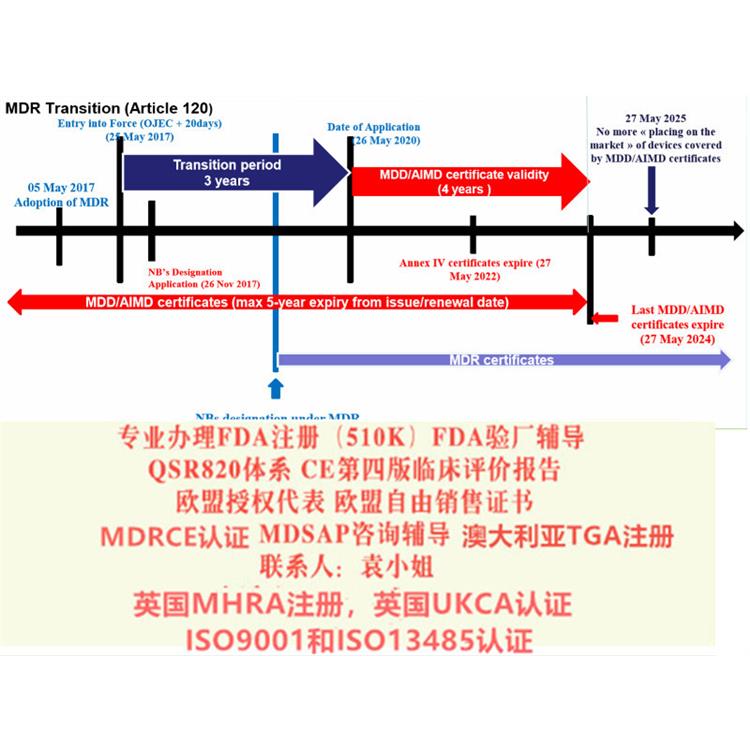
ISO13485: 二016标准(简称新版标准)已于2016年3月发布,之前使用的是ISO13485: 二003版本(简称旧版标准),ISO13485新版本标准转换期为自文件实施之日起至2019年3月31日即自2019年3月31日期,所有ISO13485: 二003旧版标准认书均失效,不论其书中标识的有效期是否到期。
ISO 9001: 二015和ISO 14001: 二015标准(简称新版标准)已于2015 年9 月发布,之前使用的是ISO9001: 二008和ISO 14001:二004版本(简称旧版标准),ISO9001和ISO14001新版本标准转换期为自文件实施之日起至2018年 9 月15日起即自2018年 9 月15日起期,所有ISO9001: 二008和ISO 14001:二004旧版标准认书均失效,不论其书中标识的有效期是否到期。
监视和测量装置控制程序(7.6)。
16.反馈系统程序,提供质量问题的早期报警,且能输入纠正和预防措施过程(8.2.1)
17.内部审核程序(8.2.2)。
18.产品监视和测量程序(8.2.4.1)。
19.不合格品控制程序(8.3)。
20.数据分析程序(8.4)。
21.忠告性通知发布和实施程序(8.5.1)。
不良事件告知行政主管部门的程序(法规要求时)。
22.纠正措施程序(8.5.2)。
23.预防措施程序(8.5.3)。
新标准作了许多性规定
新标准作了许多性规定。
4.2.1增加了“对每一型号/类型的器械建立和保持一套文档,”
4.2.3增加了保存作废文件规定。
4.2.4记录控制规定:"组织保存记录的期限应至少相当于组织所规定的器械的寿命期。"
5.5.2管理者代表的职责和权限c)要求,"确保在整个组织内提高满足法规要求和顾客要求的意识。"
5.6.2管理评审输入增加了"h)新的或修订的法规要求。"
4.6.4工作环境中增加了对产品清洁、防止污染。
7.1产品实现的策划中增加了风险管理的内容。
7.2.3顾客沟通中增加了"d)忠告性通知。"
7.3.1设计和开发策划b)指出,"适合于每个设计和开发阶段的评审、验、确认和设计转换活动(注:设计和开发过程中设计转换活动可确保设计和开发输出在成为终产品规范前得以验,以确保其适于制造)。"
7.3.2设计和开发输入a)改为,"根据预期用途,规定的功能、性能和要求",并增加了"e)风险管理的输出。"
7.3.3设计和开发输出增加了"应保持设计和开发输出的记录(注:设计和开发输出的记录可包括规范、制造程序、工程图纸、工程或研究历程记录)"。
7.3.4设计和开发评审的参加者增加了"其他人员。"
7.3.5设计和开发的确认规定,"作为设计和开发确认活动的一部分,如或地区的法规要求,组织应实施器械评价和/或性能评价。"
7.4.2采购信息规定"按照7.5.3.2规定的可追溯性要求的范围和程度, 组织应保持相关的采购信息,如文件和记录。"
7.5.1.1生产和服务提供的控制"总要求",增加了"g)规定的标签和包装操作的实施",并规定"组织应建立并保持每一批器械的记录,以提供7.5.3规定的可追溯性的范围和程度的记录,并标明生产数量和批准销售的数量。每批的记录应加以验和批准。"
新标准增加了"产品的清洁和污染的控制(7.5.1.2.1)","安装活动(7.5.1.2.2)","服务活动 (7.5.1.2.3)","无菌器械的要求(7.5.1.3)"条款。
7.5.2生产和服务提供过程的确认增加了关于"确认对产品满足规定要求的能力有影响的生产和服务提供的计算机软件的应用",以及对"过程"进行确认的内容。
7.5.3条款规定了"组织应建立形成文件的程序,以确保返回组织的器械均能被识别,且能与合格的产品区分开来"的要求,并对有源植入性器械和植入性器械规定了可追溯性的要求(7.5.3.2.2),对状态标识作了规定(7.5.3.3)。
7.5.4顾客财产的"注"增加了"保密的健康信息"。
8.2.1条款的标题改为"反馈",增加了提供质量问题早期报警和评审生产后阶段的经验等内容,而不是ISO 9001标准8.2.1的顾客满意。因为顾客满意和顾客感知在法规中作为要求来实施都显得太主观。
8.2.4产品的监视和测量规定,"只有在策划的安排(见7.1)已圆满完成时,才能放行产品和交付服务",而没有了"除非得到有关授权人员的批准,适用时得到顾客的批准 (ISO 9001标准8.2.4条款)"这种可以例外的任何前提。
对有源植入性器械和植入性器械还提出了要求,即"组织应记录检验和试验人员的身份"。
8.3不合格品控制规定:"组织应确保不合格品仅在满足法规要求的情况下才能实施让步接收,且应保持批准让步接收的人员身份的记录。"
8.5改进的8.5.1"总则"规定了"建立并实施忠告性通知发布和实施的程序",以及处理顾客报怨的做法。还作出了"如果或地区法规要求通告符合规定报告准则的不良事件,组织应建立告知行政主管部门的形成文件的程序"的规定。
我公司办理产品出口欧盟、美国、中东南美等国家的各种认:
TUV莱茵,TUV南德,***等CE认,CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售书,ISO13485:2016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认咨询(89/686/EC个人防护指令)。
认意义
1、提高和改善企业的管理水平,法律风险,增加企业的度;
2、提高和保产品的质量水平,使企业获取更大的经济效益;
3、有利于*贸易壁垒,取得进入国际市场的通行;
4、有利于增强产品的竞争力,提高产品的市场占有率。
5、通过有效的风险管理,有效降低产品出现质量事故或不良事件的风险。
6、提高员工的责任感,积极性和奉献精神。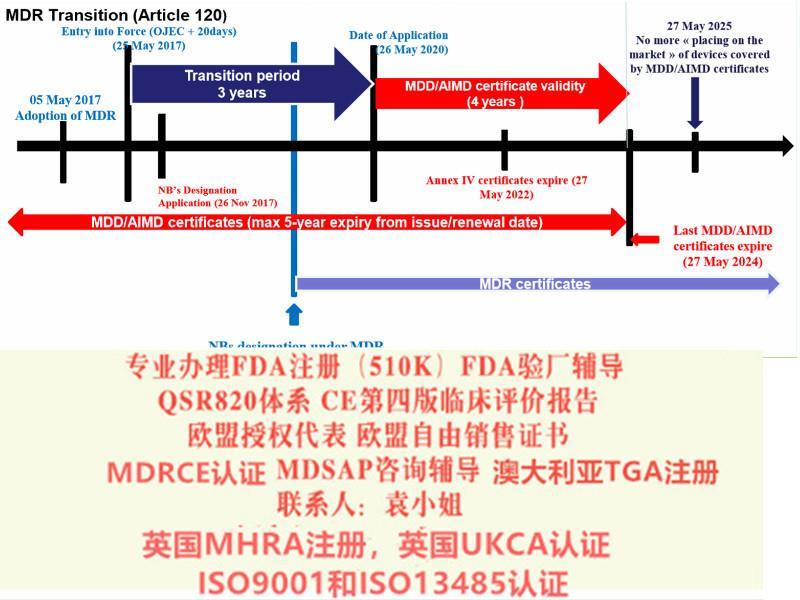
ISO9001和ISO13485的咨询流程
(一)调研诊断。根据接受咨询服务组织的规模、产品和服务复杂程度确定时间,一般控制在三个工作日左右。
(二)分析策划,由咨询师与接受咨询服务组织协商完成。
(三)培训。至少应进行如下培训:
1.标准培训:对接受咨询服务组织、骨干进行标准及管理体系知识普及培训。
2.内审员培训:培训内容要包括标准内容和内审知识,对内审员进行考试,试卷及结果应进行存档,作为内审员培训书的发依据。
(四)管理体系的分析与评审。咨询人员应当与接受咨询服务组织共同分析和评审管理体系的现状,对照标准要求确定改进和完善管理体系的方向。
(五)体系文件编写。咨询人员提出拟编写的文件清单,提出文件编写的要求和时限。接受咨询服务组织文件编写人员起草管理体系文件,咨询组采取适当方式文件编写过程。体系文件既要符合所选择的管理体系标准要求,又要符合接受咨询服务组织的实际情况,同时符合相关法律法规和行政管理要求。
(六)接受咨询服务组织发布体系文件,确定文件发布形式、参加人员、时间安排等。
(七)体系运行。管理体系试运行时间必须达到三个月以上,咨询组现场文件执行、生产/服务现场管理、质量记录使用、保存、归档等工作。体系运行前,咨询师应要求接受咨询服务组织策划并开展体系文件学习培训。
(八)内部审核。由管理者代表与相关部门策划审核方案,编制年度内审计划,确定内审组长,由内审组长编制内审实施计划,并组织内审员编制检查表。咨询人员内审组实施内审,完成相关工作。
(九)管理评审。在次内审后,由接受咨询服务组织立完成管理评审,咨询组以适当形式进行。
(十)模拟审核/第二次内审。模拟审核由咨询机构选派模拟审核组与咨询组、接受咨询服务组织共同完成;模拟审核的相关记录由模拟审核组长负责汇总,提交到技术会审核后交咨询机构存档、备查;认咨询机构可视具体情况,用第二次内审来代替模拟审核。
(十一)认审核的准备。
(十二)认审核不合格项的整改。
(十三)根据合同为接受咨询服务组织提供后续服务。